Цифровой вольтамперограф
Аннотация
Дата поступления статьи: 07.02.2013Создан малогабаритный цифровой вольтамперограф для электрохимического анализа водных растворов. Приводится конструкция прибора, чертежи электрохимической ячейки для исследования малых количеств раствора. Электронные схемы собраны на современных прецизионных компонентах. В приборе реализованы методы циклической, нормальной импульсной и дифференциальной импульсной вольтамперометрии. Проведены эксперименты с растворами ионов меди и перекиси водорода для проверки работоспособности и характеристик вольтамперографа. Все реализованные методы дали воспроизводимые результаты, согласующиеся с теорией. Приведены характерные результаты экспериментов с растворами ионов меди.
Ключевые слова: вольтамперометрия, вольтамперограф, вольтамперограмма, электрохимическая ячейка, анализ водных растворов
Вольтамперометрия, как метод электрохимического анализа растворов, находит применение в химической промышленности, лабораторных исследованиях состава растворов и механизма химических реакций [1, 2]. Методы вольтамперометрии используются в биохимических исследованиях для анализа состава биологических жидкостей. Это позволяет получать ценную информацию о состоянии организма.
Существующие вольтамперографы обычно обладают значительными размерами, массой и стоимостью. Кроме того, требуемый объём анализируемого раствора составляет не менее нескольких мл, что ограничивает исследования растворов, имеющихся в малом количестве. Это особенно актуально в биохимии и медицине, где объём биологических жидкостей, доступных для анализа, сильно ограничен.
Малый объём раствора предполагает малые размеры электродов ячейки и характерные токи в ней порядка микро - и наноампер. Для измерения таких токов требуется прецизионное малошумящее электронное оборудование [2, 3]. Структурная схема вольтамперографа, удовлетворяющего этим условиям, показана на рис. 1.
В приборе реализованы методы циклической, нормальной импульсной и дифференциальной импульсной вольтамперометрии (далее ЦВА, НИВ и ДИВА соответственно) [1, 3].
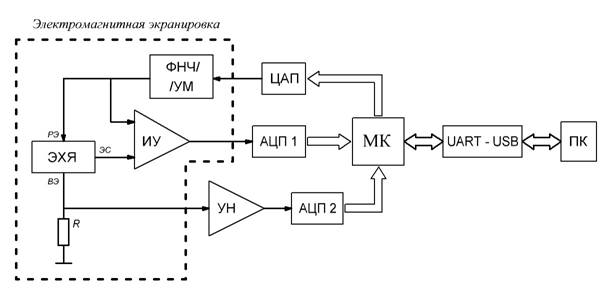
Рис. 1 – Структурная схема вольтамперографа
В электрохимическую ячейку (ЭХЯ) помещается исследуемый раствор. Рабочий, вспомогательный электроды и электрод сравнения (РЭ, ВЭ и ЭС, соответственно) находятся внутри ячейки.
В зависимости от выбранного метода анализа 16-битный цифро-аналоговый преобразователь (ЦАП) формирует напряжение, подаваемое на рабочий электрод РЭ. Для снижения уровня шумов сигнала на РЭ используется прецизионный ЦАП DAC8830 (Texas Instruments). Это напряжение проходит через фильтр низких частот, усиливаясь по мощности (ФНЧ/УМ), и подаётся на ячейку. Инструментальный усилитель (ИУ – микросхема INA128 фирмы Texas Instruments) формирует сигнал, равный напряжению на РЭ относительно ЭС, и передаёт его на вход 16-битного аналого-цифрового преобразователя (АЦП 1). Ток, текущий через ЭХЯ при этом напряжении, преобразуется в напряжение на прецизионном SMD-резисторе (R) сопротивлением 10 кОм. Напряжение с R подаётся на вход усилителя напряжения (УН) с программируемым коэффициентом усиления (микросхема PGA113 фирмы Texas Instruments), а затем на вход АЦП 2. Измерения тока и напряжения на РЭ необходимо проводить за время, не превышающее 1 мс в моменты, определяемые методом вольтамперометрии. Поэтому используются скоростные АЦП AD7665 (производитель - Analog Devices), выполняющие одно измерение за 2,5 мкс.
Таким образом, напряжение на РЭ измеряется непосредственно относительно ЭС. Током через ячейку считается ток, текущий через ВЭ.
В соответствии с выбранным методом анализа микроконтроллер (МК - ATmega16 фирмы ATMEL) управляет формированием сигнала на ЦАП, в нужные моменты времени включает/выключает АЦП 1 и АЦП 2, принимает результаты их измерений. Пары измеренных напряжений непрерывно передаются через интерфейс UART и далее через USB-порт (UART-USB) на персональный компьютер (ПК). Интерфейсная программа принимает данные с USB-порта и преобразует их в пары значений напряжения и тока, которые записываются в текстовый файл. По принятым данным строится вольтамперограмма – зависимость тока в ЭХЯ от напряжения на РЭ относительно ЭС. Параметры электрических сигналов, используемых в методах вольтамперометрии, можно менять в широких пределах, добиваясь оптимальных значений для различного состава исследуемых растворов. Параметры могут задаваться в интерфейсной программе прибора перед каждым экспериментом.
Электронная часть прибора и ПК гальванически развязаны для устранения возможных электрических помех от ПК в процессе измерения. Предусмотрена электромагнитная экранировка ячейки и аналоговых цепей, обрабатывающих сигналы на электродах. Прибор питается от аккумуляторной батареи для устранения помех из электрической сети.
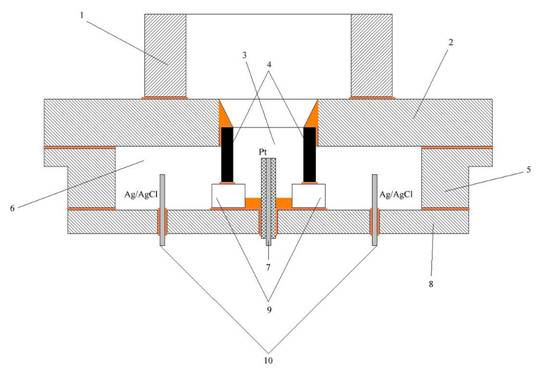
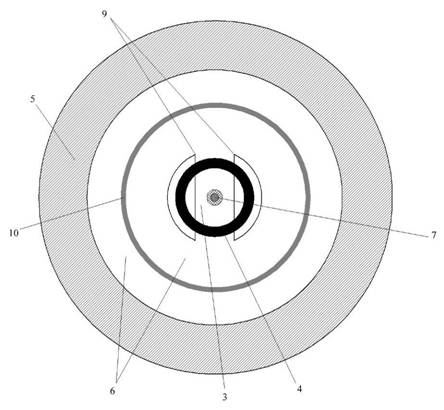
Структура электрохимической ячейки для исследования малых количеств раствора представлена на рис. 2 в горизонтальном (а) и вертикальном (б) разрезе.
а)
б)
Рис. 2 – Структура электрохимической ячейки; а) вертикальный разрез, б) горизонтальный разрез
1 – горловина для пробки и для ввода раствора в ячейку; 2 – крышка; 3 – пространство для исследуемого раствора; 4 – вспомогательный электрод из графита, импрегнированного парафином; 5 – боковая стенка; 6 – 20% водный раствор KCl (электролит электрода сравнения); 7 – рабочий электрод (платиновая проволока, впаянная в стекло); 8 – дно ячейки; 9 – симметрично расположенные диафрагмы из пористого стекла; 10 – хлорсеребряный электрод сравнения (серебряное кольцо, покрытое слоем AgCl)
Горловина 1, крышка 2, боковая стенка 5 и дно 8 ячейки выточены из эпоксидной смолы. Этот материал химически инертен, доступен, хорошо поддаётся механической обработке и склеиванию. При сборке ячейки в качестве клея использовалась только эпоксидная смола, из которой выточены детали.
Пространство для исследуемого раствора имеет объём около 0,25 см3. Раствор вводится и выводится оттуда с помощью шприца без иглы. Когда не проводится анализ растворов, в этом пространстве находится тот же раствор, что и в электроде сравнения (20% водный раствор KCl). Во время измерений и при хранении ячейки пространство для раствора закрыто пробкой.
Вспомогательный электрод 4 выточен из графитового электрода для аргоновой сварки. Этот графит выбран из-за своей высокой химической чистоты, термической и химической стойкости. Вспомогательный электрод имеет вид трубки, в которую помещается исследуемый раствор.
Рабочий электрод 7 представляет собой платиновую проволочку диаметром 0,1 мм, вплавленную в стеклянную трубку. Её верхний торец отшлифован для получения рабочей поверхности электрода. Площадь рабочей поверхности, имеющей форму окружности, около 0,008 мм2. Диаметр проволочки вместе со слоем стекла равен приблизительно 1 мм.
Диафрагмы 9 сделаны из пористого стекла с размером пор не более 16 мкм. Диафрагмы предотвращают смешивание исследуемого раствора с электролитом электрода сравнения.
Хлорсеребряный электрод сравнения (далее х.с.э.) 10 представляет собой серебряную пластинку толщиной 0,3 мм, согнутую в кольцо. Выводы от электрода сравнения и вспомогательного электрода проходят сквозь дно ячейки. Поверхность серебра внутри ячейки покрыта слоем AgCl электрохимическим методом (хлорированием) в 1% растворе HCl. Из-за большой площади и сложной формы серебряного электрода хлорирование проводилось вдвое дольше по сравнению с известной методикой [4].
Все электроды расположены коаксиально (рис. 2.б), для уменьшения электромагнитных помех при измерениях.
Все электроды вклеены в дно ячейки, выходя с нижней стороны. Электроды соединены токопроводящим клеем КОНТАКТОЛ с медными выводами из проволоки, места соединений залиты эпоксидной смолой. Медные выводы обеспечивают электрический контакт аналоговых цепей прибора с электродами.
Всеми методами вольтамперометрии получены вольтамперограммы фонового раствора и проведены эксперименты по обнаружению веществ (CuCl2 и перекиси водорода H2O2) в фоновом 10% растворе KCl. Свойства катионов меди хорошо изучены, поэтому их раствор использован для проверки работы прибора. Выбор хлорида калия обусловлен тем, что электролитом электрода сравнения ячейки является 20% раствор KCl. Близкий состав растворов минимизирует диффузионную разность потенциалов на диафрагме (рис. 2), разделяющей исследуемый раствор и электролит электрода сравнения, а значит и ошибку измерения потенциала рабочего электрода относительно электрода сравнения. Исследования проведены с растворами, содержащими одно определяемое вещество, но методы вольтамперометрии позволяют измерять содержание двух и более веществ в одном эксперименте.
Характерные вольтамперограммы раствора CuCl2 в фоновом растворе, полученные различными методами вольтамперометрии, приведены на рис. 3 – 5. Для результатов метода ЦВА одной реакции, протекающей на рабочем электроде, соответствует пара пиков тока на графиках, для метода НИВ одной реакции соответствует ступенька (волна) тока, а для метода ДИВА – один пик тока. На всех вольтамперограммах по горизонтальной оси представлено напряжение Uрэ-Uэс на РЭ (потенциал РЭ), измеренное относительно х.с.э.
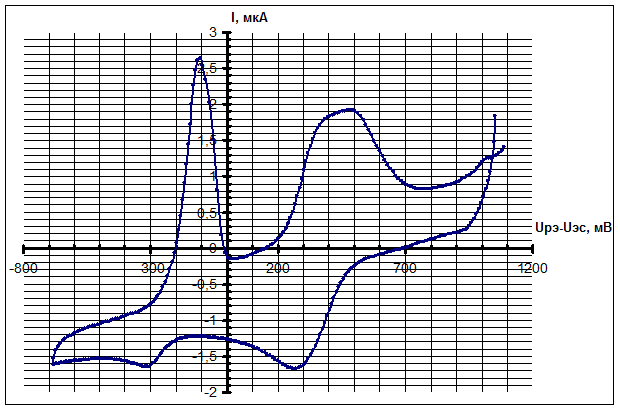
Рис. 3 - Вольтамперограмма 0,01 М раствора CuCl2 в фоновом растворе, снятые методом ЦВА при скорости сканирования 5 В/с
На полученных вольтамперограммах можно выявить две реакции ионов Cu2+: восстановление до ионов Cu1+ (потенциалы около 0,3 В относительно х.с.э.) и восстановление до нейтральных атомов Cu0 (потенциалы около -0,3 В относительно х.с.э.). Реакция при положительных потенциалах – обратимая, при отрицательных – квазиобратимая. Результаты экспериментов разными методами вольтамперометрии подтверждают друг друга.
Для методов НИВ и ДИВА токи волн и пиков взаимного превращения ионов одно- и двухвалентной меди сравнивались со значениями, рассчитанными на основе теории обратимых реакций [3]. Для результатов НИВ получено совпадение по порядку и по значению с отклонением не более 20%. Для результатов ДИВА получено совпадение по порядку для обеих полярностей, численные значения лучше всего совпали для катодной полярности – отклонения не превысили 30%. Результаты ЦВА сложнее обрабатывать и рассчитывать, ещё остаются факторы, искажающие форму вольтамперограмм.
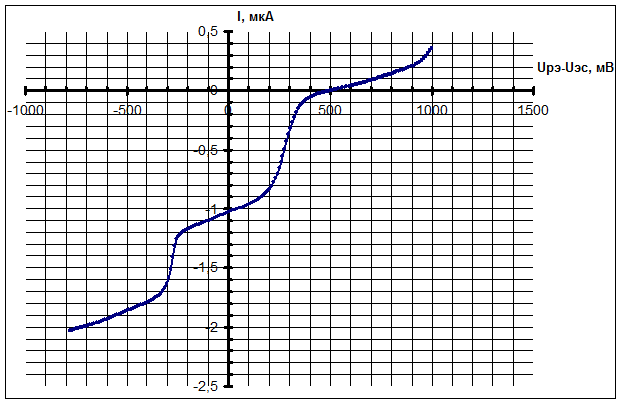
Рис. 4 - Вольтамперограмма 0,01 М раствора CuCl2 в фоновом растворе, снятая методом НИВ; длительность импульса: 50 мс; напряжение в промежутке между импульсами: +0,5 В относительно х.с.э.
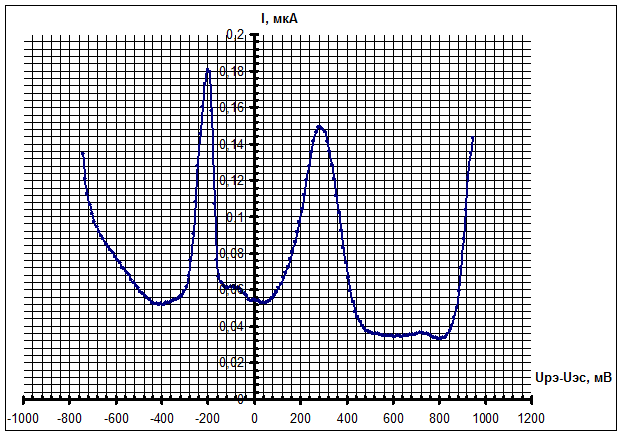
Рис. 5 - Вольтамперограмма 10-3 М раствора CuCl2 в фоновом растворе, снятая методом ДИВА; высота импульса: 50 мВ; длительность импульса: 10 мс; шаг сигнала по амплитуде: 10 мВ; полярность сигнала ДИВА: анодная;
Для методов ЦВА и НИВ экспериментально доказана чувствительность к концентрации ионов меди 0,001 моль/литр в использованном фоновом растворе. Метод ДИВА показал максимальную чувствительность: экспериментально подтверждено значение 10-5 моль/литр.
Тремя методами вольтамперометрии проведены исследования раствора H2O2 в фоновом 10% растворе KCl. Все методы показали чувствительность к перекиси при концентрации не менее 0,001 моль/литр. Худшая, чем для ионов меди, чувствительность к перекиси может объясняться выделением и адсорбцией водорода на поверхности рабочего электрода. Эта реакция начинается и идёт при потенциалах отрицательнее -0,1 В относительно х.с.э. [1, 2]. Адсорбирующийся водород блокирует поверхность рабочего электрода для других реакций.
Для наблюдения реакций при отрицательных потенциалах необходима замена платинового рабочего электрода на углеродный (графитовый) – на нём водород выделяется при напряжениях отрицательнее -1 В относительно х.с.э. [2] и не адсорбируется.
Работа выполнена в рамках реализации ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009 – 2013 годы, проекты № 14.В37.21.0284 и № 14.В37.21.0736.
Литература:
1. Будников, Г.К. Основы современного электрохимического анализа [Текст]/ Г.К. Будников, В.Н. Майстренко, М.Р. Вяселев – М.: Мир, Бином ЛЗ, 2003. – 592 с.
2. Электроаналитические методы. Теория и практика [Текст]/ под ред. Ф. Шольца; [пер. с англ.]/ под ред. В.Н. Майстренко. – М.: БИНОМ ЛЗ, 2006. – 326 с.
3. Electrochemical methods: fundamentals and applications/ Allen J. Bard, Larry R. Faulkner. – 2nd ed.: John Wiley & Sons, Inc., 2001.
4. Балмасов, А.В. Лабораторный практикум по теоретической электрохимии [Текст]: учеб. пособие для вузов/ А.В. Балмасов, Ю.Я. Лукомский; – Иваново: Ивановский государственный химико-технологический университет, 2008. – 84 с.