Кинетика процесса электроосаждения цинка из сульфатного электролита с добавками ПАВ
Аннотация
Дата поступления статьи: 05.05.2013Изучена кинетика электроосаждения цинка на стальную основу из сульфатного электролита с синтезированными добавками ПАВ. Установлено, что при потенциалах положительнее равновесного значения происходит дофазовое осаждение цинка. Добавки синтезированных органических соединений адсорбируются на поверхности электрода при его катодной поляризации, увеличивая перенапряжение процесса. Величина адсорбции лежит в пределах от 0,5•10-7 до 2,6•10-5 моль/см2.
Ключевые слова: цинкование, электролит, электрод, поверхностно-активное вещество (ПАВ), электроосаждение, адсорбция, коэффициент диффузии, дофазовое
Введение
Цинкование – один из наиболее распространенных гальванических процессов [1-5], поэтому интерес к совершенствованию технологии, изучению механизма и кинетики в электролитах различного состава не ослабевает [6-13]. Электролитическое цинкование из сульфатных электролитов протекает с высокой скоростью, выходом по току близким к 100 % [1-5], что обеспечивает их широкое использование в гальванотехнике. Изучение электровосстановления цинка из сульфатных электролитов с добавками поверхностно-активных веществ (ПАВ) показало [6,7], что скорость процесса может определяться реакцией перехода, гетерогенной химической реакцией. В электрохимических реакциях на катоде участвуют не только ионы цинка, но и гидроксокомплексы ZnOH+, образующиеся в результате подщелачивания приэлектродного слоя при выделении водорода [8]. Кинетику процесса и физико-химические свойства электроосаждаемого цинкового покрытия во многом определяет природа вводимых ПАВ [6,9-12]. Поэтому одним из направлений совершенствования сульфатных электролитов цинкования является подбор ПАВ, определение оптимальных концентраций добавок, синтез новых соединений, которые могли бы устранить недостатки кислых электролитов [5]. Основными требованиями к синтезированным добавкам являются наличие положительно заряженных групп, благодаря которым обеспечивалось бы электростатическое взаимодействие с поверхностью катода, простота получения соединений. Действие ПАВ зависит от условий эксплуатации электролита, в частности, от потенциала поляризации, следовательно, может повлиять на дофазовое осаждение металла (осаждение при потенциалах близких к равновесному значению), на процесс зародышеобразования, на рост кристаллического осадка [13].
Целью настоящей работы явилось изучение кинетики электроосаждения цинка из сульфатного электролита с добавками декстрина, ПЭПА (полиэтиленполиамин) и синтезированными органическими соединениями.
Методика эксперимента
Электроосаждение цинка на стальную основу (сталь 08 КП) проводилось из сульфатного электролита, содержащего 250 г/л ZnSO4·7H2O + 40г/л Al2(SO4)3·18H2O + 75г/л Na2SO4·10H2O [1]. В качестве добавок ПАВ вводились декстрин в количестве 9 г/л [2], ПЭПА и синтезированные добавки: 5-толил-3-фенилметиленфуран-2-он (ПАВ1), 3-о-хлорфенилметилен-5-фенил-3Н-фуран-2-он (ПАВ2) в количестве 1-5 мл/л [16].
Рабочая поверхность стальных электродов подвергалась механическому шлифованию, химическому травлению в растворе HCl концентрацией 50 г/л. Качество подготовки поверхности оценивалось по величине потенциала погружения электрода в электролите цинкования. Измерения потенциала проводились относительно насыщенного хлоридсеребряного электрода сравнения (н.х.с.э.с.). Кинетика электроосаждения цинкового покрытия из сульфатного электролита заданного состава изучалась потенциодинамическим и потенциостатическим методами на потенциостате П-5848 и P-8S. Потенциодинамические кривые снимались от потенциала погружения стального электрода в электролите цинкования до -1,3 В со скоростью развертки 4 мВ/с, потенциостатические – в диапазоне потенциалов рабочего электрода от -0,98 В до -1,20 В при 25 С°. pH в исследуемых электролитах равен 3. Состав поверхности рабочих электродов анализировался с помощью спектрометра Niton XLt.
Экспериментальные результаты
Соединения, выступающие в роли ПАВ при электроосаждении металлов, могут взаимодействовать с катионами восстанавливающихся металлов, с поверхностью катода. Синтезированные органические соединения, структурные формулы которых приведены на рис. 1а,б, имеют в своем составе бензольные кольца, способные притягивать к себе электроны от функциональных групп, и таким образом создавать больший положительный заряд на этих группах [17]. Это должно обеспечить адсорбционное взаимодействие указанных органических соединений с поверхностью электрода при его катодной поляризации.
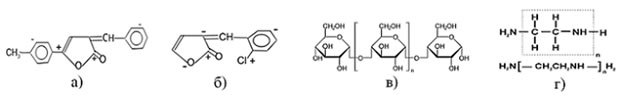
Рис. 1. – Структурные формулы поверхностно-активных веществ, используемых в электролите цинкования а) 5-толил-3-фенилметиленфуран-2-он (ПАВ1), б) 3-о-хлорфенилметилен-5-фенил-3Н-фуран-2-он (ПАВ2), в) декстрин, г) ПЭПА (полиэтиленполиамин).
Согласно расчетам, приведенным в программе МОПАК (пакет молекулярных орбиталей), при параметризации РМЗ [17], установлено, что молекулы синтезированных веществ располагаются в одной плоскости. Поскольку катод заряжен отрицательно, а синтезированные соединения содержат группы, имеющие положительный заряд, то вероятно взаимодействие указанных ПАВ с поверхностью электрода.
С целью сравнительной оценки влияния ПАВ на скорость электроосаждения цинка из сульфатного электролита на стальную основу снимались потенциодинамические кривые от потенциала погружения до -1,3В со скоростью развертки потенциала 4 мВ/с (рис. 2). Как следует из полученных результатов в области потенциалов, предшествующих формированию цинкового покрытия наблюдаются токи, величина которых зависит от природы вводимой добавки ПАВ. Так как скорость электровосстановления водорода мала (рис. 2б, кривая 6), то можно предположить, что протекает процесс дофазового осаждения с внедрением атомов цинка в поверхностные слои стали (равновесный потенциал цинка в исследуемых электролитах составляет -0,982 В относительно н.х.с.э.с.).
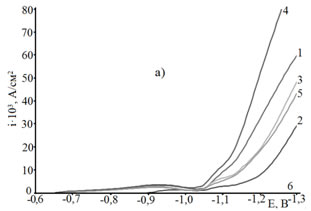
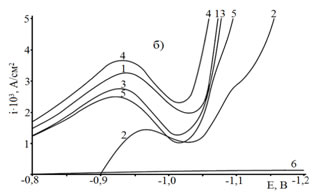
Рис. 2. – а) i,E-кривые на стальном электроде в электролите цинкования состава ZnSO4·7H2O 250 г/л + Al2(SO4)3·18H2O 40г/л + Na2SO4·10H2O 75г/л + ПАВ при 25 С°, скорости развертки потенциала Vp = 4 мВ/с: 1 – без добавки, 2 – добавка декстрин, 3 – ПАВ1, 4 – ПАВ2, 5 – ПЭПА, 6 – вода рН 3.
б) выделенный интервал потенциалов от -0,8 В до -1,1 В рисунка 2а.
Это предположение подтверждено спектральным анализом стального электрода, который был выдержан при Е = -0,925 В в течение 3 минут (таблица № 1).
Таблица № 1
Количество Zn в поверхностном слое стального электрода, полученное при потенциале поляризации -0,925 В относительно н.х.с.э.с. в течение 3 минут в электролите, содержащем различные добавки ПАВ.
Состав электролита |
Природа добавки |
Количество вводимой добавки |
Количество цинка, % |
|
ZnSO4·7H2O 250 г/л Al2(SO4)3·18H2O 40г/л Na2SO4·10H2O 75г/л |
ПАВ1 |
3 мл/л |
1,74 |
|
ПАВ2 |
3 мл/л |
1,87 |
|
|
ПЭПА |
3 мл/л |
0,48 |
|
|
Декстрин |
9 г/л |
1,33 |
|
|
Без добавки |
0 |
0,52 |
Состав исходного электрода: Fe 98,05 %, Mn 0,74 %, Co 0,09 %
На скорость процесса оказывает влияние природа присутствующей добавки: для синтезированных добавок меньшая скорость наблюдается для ПАВ1. Снижение скорости процесса при смещении потенциала в область более отрицательных значений относительно максимума i,E-кривых свидетельствует о пассивации электрода (рис. 2), которая является следствием взаимодействия с поверхностью электрода молекул H2O, Н+, ОН– групп, Н2, гидроксидных соединений Zn, а также присутствующих добавок ПАВ. Из приведенных данных следует, что в изучаемом концентрационном диапазоне для добавок ПАВ, большее влияние на скорость электрохимического процесса оказывает декстрин, а из синтезированных добавок – ПАВ1.
Анализ i,t-зависимостей электровосстановления цинка из исследуемых электролитов (рис. 3) в координатах i,![]() (рис. 4а) показал, что кривые экстраполируются в начало координат при потенциалах поляризации -0,98; -0,99; -1,0 В. Подобный ход кривых позволяет высказать предположение, что при потенциалах -0,98 ÷ -1,0 В для всех исследуемых растворов электролитов в начальный момент поляризации (до 5 секунд) скорость процесса определяется диффузией ионов в поверхностные слои электрода.
(рис. 4а) показал, что кривые экстраполируются в начало координат при потенциалах поляризации -0,98; -0,99; -1,0 В. Подобный ход кривых позволяет высказать предположение, что при потенциалах -0,98 ÷ -1,0 В для всех исследуемых растворов электролитов в начальный момент поляризации (до 5 секунд) скорость процесса определяется диффузией ионов в поверхностные слои электрода.
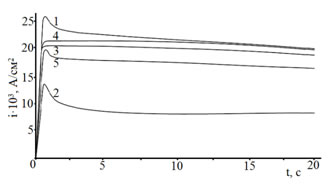
Рис. 3. – i,t-кривые электровосстановления Zn на сталь из электролита состава ZnSO4·7H2O 250 г/л + Al2(SO4)3·18H2O 40г/л + Na2SO4·10H2O 75г/л + добавка: без добавки(1), декстрин 9 г/л(2), ПАВ1 1 мл/л(3), ПАВ2 1 мл/л(4),
ПЭПА 1 мл/л(5) мл/л при потенциале Е = -1,2 В, t = 25˚C.
Из сравнения i,![]() для процессов электровосстановления Zn из исследуемых растворов и электровосстановления H2 из воды с рН 3 (рис. 4б) следует, что в поверхностные слои преимущественно диффундирует цинк так как кривые электровосстановления Н2 не экстраполируются в начало координат во всем диапазоне рабочих потенциалов.
для процессов электровосстановления Zn из исследуемых растворов и электровосстановления H2 из воды с рН 3 (рис. 4б) следует, что в поверхностные слои преимущественно диффундирует цинк так как кривые электровосстановления Н2 не экстраполируются в начало координат во всем диапазоне рабочих потенциалов.
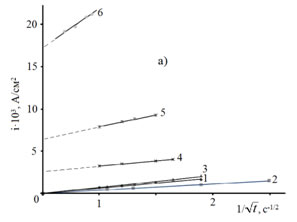
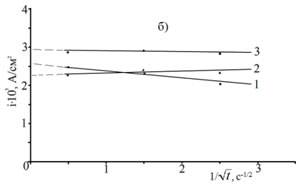
Рис. 4. – i,![]() -кривые электровосстановления Zn (а) из электролита состава: ZnSO4·7H2O 250 г/л + Al2(SO4)3·18H2O 40г/л + Na2SO4·10H2O 75г/л + ПАВ1 1 мл/л, электровосстановления Н2 (б) из раствора H2SO4 с рН 3 при потенциалах, В: -0,98(1); -0,99(2); -1,00(3); -1,05(4); -1,10(5); -1,20(6).
-кривые электровосстановления Zn (а) из электролита состава: ZnSO4·7H2O 250 г/л + Al2(SO4)3·18H2O 40г/л + Na2SO4·10H2O 75г/л + ПАВ1 1 мл/л, электровосстановления Н2 (б) из раствора H2SO4 с рН 3 при потенциалах, В: -0,98(1); -0,99(2); -1,00(3); -1,05(4); -1,10(5); -1,20(6).
О твердофазном механизме процесса диффузии ионов цинка позволяют говорить величины произведения![]() (таблица № 2), рассчитанные согласно уравнению: .
(таблица № 2), рассчитанные согласно уравнению: .
Прямолинейный ход i,![]() -кривых электровосстановления Zn из исследуемых растворов электролитов, не экстраполирующийся в начало координат при потенциалах поляризации -1,05 В, -1,10 В, -1,20 В (рис. 4а) может свидетельствовать о преобладании адсорбционных процессов на межфазной границе: адсорбции разряжающихся гидратированных ионов цинка, гидроксидных соединений цинка, присутствующих поверхностно-активных веществ, атомов водорода [18].
-кривых электровосстановления Zn из исследуемых растворов электролитов, не экстраполирующийся в начало координат при потенциалах поляризации -1,05 В, -1,10 В, -1,20 В (рис. 4а) может свидетельствовать о преобладании адсорбционных процессов на межфазной границе: адсорбции разряжающихся гидратированных ионов цинка, гидроксидных соединений цинка, присутствующих поверхностно-активных веществ, атомов водорода [18].
Таблица № 2
Значения![]() электровосстановления цинка на стальном электроде из исследуемых электролитов при t=25˚С.
электровосстановления цинка на стальном электроде из исследуемых электролитов при t=25˚С.
Природа добавки |
С, мл/л |
|
||
|
Е = -0,98 В |
Е = -0,99 В |
Е = -1,0 В |
||
|
ПАВ1 |
1 |
11,01 |
6,88 |
11,93 |
|
3 |
10,28 |
- |
11,01 |
|
|
5 |
9,64 |
8,53 |
- |
|
|
ПАВ2 |
1 |
16,43 |
11,01 |
16,06 |
|
3 |
8,72 |
11,38 |
11,65 |
|
|
ПЭПА |
1 |
18,88 |
16,60 |
30,6 |
|
5 |
16,37 |
23,79 |
21,13 |
|
|
10 |
15,38 |
16,37 |
- |
|
|
15 |
10,15 |
7,11 |
- |
|
|
Декстрин |
9 г/л |
11,29 |
7,7 |
13,77 |
|
Без ПАВ |
- |
10,19 |
- |
15,05 |
Исходя из представлений об адсорбции указанных частиц, был проведен расчет величины адсорбции (ГЕ) при использовании зависимости lni,t (рис. 5) по уравнению: ![]() ,
,
где it=0 определялась путем экстраполяции i,![]() -кривых на ось плотности тока при t = 0 с. Результаты расчета ГЕ приведены в таблице № 3.
-кривых на ось плотности тока при t = 0 с. Результаты расчета ГЕ приведены в таблице № 3.
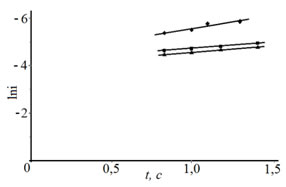
Рис. 5. – lni,t-кривые электровосстановления цинка на стальную основу из электролита состава, г/л: ZnSO4·7H2O 250 г/л + Al2(SO4)3·18H2O 40г/л + Na2SO4·10H2O 75г/л + добавка: декстрин 9 г/л (1), ПАВ1 3 мл/л (2),
ПАВ2 3 мл/л (3) при потенциале -1,1 В при 25˚С.
В электролите цинкования с добавкой декстрина ГЕ меньше на порядок по сравнению с ГЕ, полученной в электролите без добавки. Предполагаем, что декстрин, блокируя поверхность электрода, уменьшает доступ разряжающихся частиц и снижает их адсорбцию на поверхности, в результате, суммарная величина ГЕ уменьшается. Аналогичное влияние, только в меньшей степени чем декстрин, оказывают и добавки ПАВ1 и ПАВ2.
Таблица № 3
Значения величины адсорбции ГЕ для процессов электровосстановления цинка на стальном электроде из исследуемых электролитов при t = 25˚С.
Природа добавки |
С, мл/л |
ГЕ ·107, моль/см2 |
||
|
- 1,05 В |
- 1,1 В |
- 1,2 В |
||
|
ПАВ1 |
1 |
2,3 |
6,8 |
200 |
|
3 |
2,1 |
4,8 |
230 |
|
|
5 |
2,3 |
4,3 |
180 |
|
|
ПАВ2 |
1 |
1,3 |
2,2 |
190 |
|
3 |
1,6 |
6,6 |
220 |
|
|
5 |
1,1 |
6,6 |
260 |
|
|
ПЭПА |
1 |
- |
4,2 |
10,8 |
|
5 |
- |
1,1 |
5,7 |
|
|
10 |
0,5 |
1,6 |
3,3 |
|
|
15 |
1,5 |
2,0 |
3,1 |
|
|
Декстрин |
9 г/л |
0,5 |
1,0 |
3,7 |
|
Без ПАВ |
- |
3,0 |
7,1 |
15,0 |
Зависимость величины адсорбции от концентрации добавок ПАВ1 и ПАВ2 неоднозначна. Для добавки ПАВ1 с увеличением ее концентрации ГЕ несколько снижается. Для ПАВ2 эта закономерность не прослеживается. С увеличением катодного потенциала величина адсорбции в электролите с добавкой ПАВ1 и ПАВ2 возрастает и особенно значительно при -1,2 В. Та же закономерность прослеживается для электролита с добавкой декстрина.
Выводы
Из полученных данных следует, что при потенциалах положительнее равновесного значения протекает процесс дофазового осаждения цинка с внедрением его атомов в поверхностные слои стали.
Синтезированные добавки органических соединений способны адсорбироваться на поверхности электрода при его катодной поляризации, следовательно, влиять на скорость электровосстановления цинка и качество покрытия.
Пользуясь полученными данными, можно выделить синтезированную добавку ПАВ1, обладающую большей адсорбционной способностью.
Литература:
- Гальванические покрытия в машиностроении [Текст] / Под ред. М.А.Шлугера. - М.: Машиностроение, 1985. – Т.1. – 161 с.
- Гальванотехника [Текст] / Под ред. А.М.Гинберга. - М.: Металлургия, 1987. – 736 с.
- Ильин, В.А. Цинкование, кадмирование, оловянирование и свинцевание [Текст] - Л.: Машиностроение, 1983. – 87 с.
- Проскурин, Е.В. Цинкование [Текст] / Е.В. Проскурин, А.Т. Мороз. - М.: Металлургия, 1988. – 528 с.
- Цинкование. Техника и технология [Текст] / В.В. Окулов, под ред. В.Н. Кудрявцева. - М.: Глобус, 2008.
- Медведев, Г.И. Исследование кинетики процесса электроосаждения цинка из сернокислых электролитов в присутствии продуктов конденсации и буферирующих добавок [Текст] / Г.И. Медведев, Е.А. Янчева // Электрохимия, 1991. – №10. – С.1231-1235.
- Наливайко, Е.В. Интенсификация электроосаждения сплава цинк-никель из аммонийного электролита [Электронный ресурс] // «Инженерный вестник Дона», 2012, №3. – Режим доступа: http://www.ivdon.ru/magazine/archive/n3y2012/924 (доступ свободный) – Загл. с экрана. – Яз. рус.
- Плохов, С.В. Электроосаждение цинка из сернокислых ионообменных элюатов [Текст] / С.В. Плохов, И.Г. Матасова, В.М. Воротынцев, И.Ю. Харитонова // Известия вузов. Химия и химическая технология, 2001. – №5. – С.171-174.
- Таран, Л.А. Электроосаждение блестящих цинковых покрытий из сернокислого электролита [Текст] / Л.А. Таран, В.С. Громаков // Защита металлов, 1982. – Т.18. – Вып.1. – С.129.
- Медведев, Г.И. Электроосаждение блестящих цинковых покрытий из сульфатного электролита [Текст] / Г.И. Медведев, Н.А. Макрушин, В. Хамуньела // Прикладная электрохимия и защита металлов от коррозии, 2007. – №8. – С.1276.
- Титова, В.Н. Электровосстановление ионов цинка из цинкатных электролитов в присутствии ПАВ [Текст] / В.Н. Титова, В.А. Казаков, А.А. Явич // Электрохимия, 1996. – №5. – С.562.
- Лошкарев, Ю.М. Сравнительный анализ современных электролитов цинкования и критерии их выбора для целей гальванотехники [Текст] / Ю.М. Лошкарев, В.С. Коваленко // Гальванотехника и обработка поверхности, 1999. – №2. – С.37.
- Rashkov, S. The relationship between the underpotentixe deposition of zinc and the penetration of hydrogen in armio-ion substrates [Text] / S. Rashkov, C. Bozhkow, V. Kudryavtsev, K. Pedan, S. Bagaev // J. Electroanalyt. Chem, 1988. – V.248. – P.421-429.
- Антропов, Л.И. Наложение дофазового осаждения металлов на выделение водорода при катодной поляризации железа [Текст] / Л.И. Антропов, Н.В. Кондрашова // Защита металлов, 1983. – №3. – С.505-506.
- Drazik, D.M. Iyhibitory effects of manganeous, cadmium and zink ions in hydrogen evolution reaction and corrosion of iron in sulphuric acid solutions [Text] / D.M. Drazik, L.Z. Vorkapic // Corros. Sci, 1978. – №10. – P.907-912.
- Минин, И.В. Электроосаждение цинка из сульфатного электролита с добавками ПАВ [Текст] / И.В. Минин, Н.Д. Соловьева, В.В. Чадина, И.В. Лазарева // Нанотехно-логии: наука и производство, 2011. – №3(12). – С.61.
- Мельников, А.А. / Квантовохимические методы расчета молекул [Текст]. А.А. Мельников, А.В. Тихонов, А.И. Шретер. - М: Химия, 2002. – 256 с.
- Санников, Н.И. Математическое представление характеристик пограничной поверхности межфазного переходного слоя [Электронный ресурс] // «Инженерный вестник Дона», 2012, №2. – Режим доступа: http://www.ivdon.ru/magazine/archive/n2y2012/756 (доступ свободный) – Загл. с экрана. – Яз. рус.