Моделирование ab initio реакций акриламида с алифатическими ди-, три-, тетра- и пентааминами
Аннотация
Дата поступления статьи: 05.03.2014Работа посвящена исследованию возможности взаимодействия акриламида с алифатическими ди-, три-, тетра- и пентааминами и предполагаемых структурам получаемых соединений с исполь-зованием квантовохимического ab initio моделиро-вания. Определены термодинамические параметры и логарифмы констант равновесия данных взаимо-действий. Сформулированы условия, которые необ-ходимо соблюдать при разработке технологии полу-чения данных соединений и показано, что реакция их синтеза с высокой вероятностью при соотно-шении реагентов акриламид – амин равным 2:1 должна проходить в сравнительно мягких условиях.
Ключевые слова: Акриламид, алифатические амины, этилендиамин, диэтилентриамин, триэтилентетраамин, тетраэти-ленпентаамин, свободная энергия Гиббса, изобарно-изотермический потенциал, константа равновесия
05.13.18 - Математическое моделирование, численные методы и комплексы программ
Акриламид в настоящее время находит широкое применение во многих областях промышленности, таких, как целлюлозно-бумажная, горно- и нефтедобывающая, пищевая, лакокрасочная, а также в производстве отделочных материалов и искусственной кожи, тем не менее, продолжается поиск новых направлений его использования [1-2].
Поэтому, представляет интерес неизученная ранее реакция акриламида с алифатическими ди-, три -, тетра - и пентааминами. Попытки получения продуктов таких взаимодействий нами в доступных литературных источниках не обнаружены. Тем не менее, заинтересованность к получению таких соединений может только возрастать, так как они могут служить исходным сырьём для производства других полезных веществ, которые могут найти достойное применение.
Выбор условий реакции акриламида с алифатическими ди-, три-, тетра- и пентааминами во многом зависит от термодинамических закономерностей процесса. Поэтому нами рассмотрены термодинамические характеристики следующих предполагаемых превращений:
NH2-C(O)-CH=CH2+ NH2-(CH2-CH2-NH)nH →
NH2-C(O)-CH2-CH2-NH-(CH2-CH2-NH)nH (1)
2NH2-C(O)-CH=CH2+ NH2-(CH2-CH2-NH)nH →
NH2-C(O)-CH2-CH2-NH-(CH2-CH2-NH)n-CH2-CH2-(O)C-NH2, (2)
где n=1-4:
- NH2-CH2-CH2-NH2 (этилендиамин, En, n=1);
- NH2-CH2-CH2-NH-CH2-CH2-NH2 (диэтилентриамин, ДЭТА, n=2);
- NH2-CH2-CH2-NH-CH2-CH2-NH-CH2-CH2-NH2 (триэтилентетраамин, ТЭТА, n=3);
- NH2-CH2-CH2-NH-CH2-CH2-NH-CH2-CH2-NH-CH2-CH2-NH2 (тетраэтиленпентаамин, ТЭПА, n=4).
В связи с этим, целью предлагаемого исследования является оценка возможности протекания реакции синтеза акриламида с алифатическими ди-, три-, тетра- и пентааминами с помощью термодинамического квантовохимического моделирования.
Теоретические выкладки по определению направленности процесса достаточно широко рассмотрены в различных литературных источниках по термодинамике химических реакций [3,4].
Реакции (1) связаны с обратимым образованием продуктов взаимодействия акриламида и алифатических аминов в мольном соотношении 1:1. Реакции (2) должны приводить к образованию конечных продуктов – диамидов при мольном соотношении акриламида и алифатических аминов 2:1. Вероятно, возможны оба взаимодействия,
Нами квантовохимическим методом на основе теории функционала плотности c использованием гибридного обменно-корреляционного функционала B3LYP в базисе 3-21G* в интервале температур 273÷450 К и давлении 0.1 МПа находились значения энтальпий и энтропий реакций (1) и (2) в газовой фазе (табл. 1) [5-11].
Как следует из приведенных в таблице 1 данных, энтальпии и энтропии реакций (1) и (2) отрицательны и практически во всех случаях наблюдается одинаковая тенденция: с возрастанием температуры их значения планомерно возрастают. Для реакции при n=1 и мольном соотношении акриламида и этилендиамина равным 1:1 эти величины слабо зависят от температуры.
Значения изобарно-изотермического потенциала (величину свободной энергии Гиббса) и логарифмы констант равновесия (Kp) вычисляли по уравнениям: ∆G = ∆H - T∆S и lnKp =-∆G/(RT) [3,4] (таблица 2, рис. 1).
Таблица №1
Энтальпии (∆Н) и энтропии (∆S) реакций (1) и (2)
Используемый амин |
Мольное соотношение реагентов акриламида (АА) и аминов |
Т, К |
∆H, |
∆S, |
|
En |
АА/En = 1:1 |
273 |
-116,20 |
-184,12 |
|
450 |
-116,18 |
-184,23 |
||
|
АА/En = 2:1 |
273 |
-163,58 |
-293,46 |
|
|
450 |
-160,97 |
-286,35 |
||
|
ДЭТА |
АА/ДЭТА = 1:1 |
273 |
-66,49 |
-142,55 |
|
450 |
-64,86 |
-138,01 |
||
|
АА/ДЭТА = 2:1 |
273 |
-158,43 |
-290,70 |
|
|
450 |
-155,57 |
-282,80 |
||
|
ТЭТА |
АА/ТЭТА = 1:1 |
273 |
-81,92 |
-155,93 |
|
450 |
-80,71 |
-152,99 |
||
|
АА/ТЭТА = 2:1 |
273 |
-163,56 |
-300,94 |
|
|
450 |
-161,08 |
-294,16 |
||
|
ТЭПА |
АА/ТЭПА = 1:1 |
273 |
-79,75 |
-151,35 |
|
450 |
-78,41 |
-147,69 |
||
|
АА/ТЭПА = 2:1 |
273 |
-171,73 |
-294,47 |
|
|
450 |
-169,15 |
-287,43 |
Согласно данным таблицы 2, изменение энергии Гиббса в исследуемом интервале температур 273÷450 К для реакций (1) и (2) принимает отрицательные значения, то есть равновесие смещено в сторону образования конечных продуктов реакции. Однако, во всех случаях с повышением температуры значения энергии Гиббса закономерно увеличиваются, вероятно это связано, прежде всего, с вкладом энтропийных эффектов в свободную энергию исследуемых реакций. Следует отметить, что величины значений свободной энергии при небольших температурах значительно ниже для реакций (2) по сравнению с (1). Реакциями (1) нельзя пренебречь, поскольку они характеризуются отрицательными значениями свободной энергии, тем не менее, приведенные в таблице 2 результаты свидетельствуют, что наиболее вероятными при небольших температурах являются реакции (2).
Таблица №2
Энергии Гиббса (∆G, кДж/моль) реакций (1) и (2)
Tемпера-тура, K |
Мольное соотношение реагентов акриламида (АА) и аминов |
|||||||
|
АА/En |
АА/ДЭТА |
АА/ТЭТА |
АА/ТЭПА |
|||||
|
1:1 |
2:1 |
1:1 |
2:1 |
1:1 |
2:1 |
1:1 |
2:1 |
|
|
273 |
-65,94 |
-83,46 |
-27,58 |
-79,07 |
-39,36 |
-81,41 |
-38,43 |
-91,34 |
|
298 |
-61,33 |
-76,14 |
-24,03 |
-71,82 |
-35,35 |
-73,90 |
-34,65 |
-83,98 |
|
300 |
-60,97 |
-75,55 |
-23,74 |
-71,24 |
-35,04 |
-73,30 |
-34,35 |
-83,40 |
|
325 |
-56,35 |
-68,25 |
-20,21 |
-64,01 |
-31,15 |
-65,80 |
-30,58 |
-76,07 |
|
350 |
-51,73 |
-60,97 |
-16,68 |
-56,82 |
-27,27 |
-58,34 |
-26,83 |
-68,77 |
|
375 |
-47,11 |
-53,72 |
-13,18 |
-49,65 |
-23,40 |
-50,89 |
-23,09 |
-61,49 |
|
400 |
-42,50 |
-46,49 |
-9,69 |
-42,51 |
-19,54 |
-43,47 |
-19,36 |
-54,24 |
|
425 |
-37,89 |
-39,30 |
-6,22 |
-35,39 |
-15,70 |
-36,08 |
-15,65 |
-45,96 |
|
450 |
-33,27 |
-32,12 |
-2,76 |
-28,31 |
-11,86 |
-28,71 |
-11,95 |
-39,81 |
Данное утверждение подтверждается температурными зависимостями значений lnKp в интервале температур от 273 до 450 К, представленными на рис. 1 в виде графических зависимостей lnKp от 1/T. Анализ зависимостей указывает на то, что константы равновесия реакций (1) и (2) уменьшаются с увеличением температуры. Различия между реакциями (1) и (2) заключаются в том, что для превращений (2) во всём рассмотренном интервале температур наблюдаются большие константы равновесия. При небольших температурах разница в их значениях существенно возрастает.
Следовательно, на основании результатов квантовохимического ab initio моделирования реакций акриламида с алифатическими ди-, три-, тетра- и пентааминами можно предположить, что при невысоких температурах 300÷325 К преимущественно наиболее вероятны реакции (2).
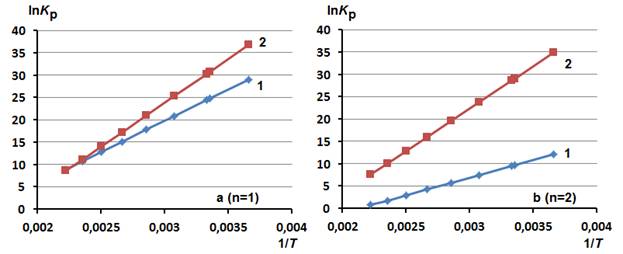
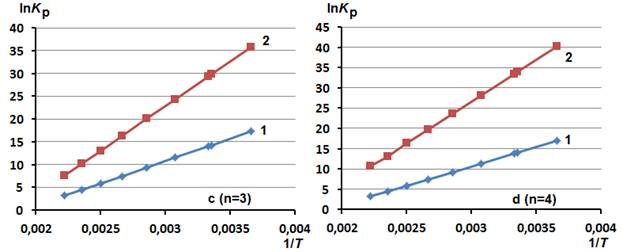
Рис. 1. - Зависимость логарифмов констант равновесия (lnKp) реакций (1) и (2) от величин, обратных температуре (1/T), для соединений, содержащих фрагмент этилендиамина (а, n=1), диэтилентриамина (b, n=2), триэтилентетраамина (c, n=3) и тетраэтиленпентаамина (d, n=4)
Следует заметить, что теоретический расчет находится в хорошем согласии с экспериментом, поскольку, при взаимодействии акриламида с аминами при различном соотношении реагентов и температурах 325÷330 К преимущественно проходит превращения по реакциям (2), что подтверждается количеством вступающих в реакцию реагентов и анализом частот ИК-Фурье, ЯМР 1Н и 13С спектров.
Таким образом, возможности математического моделирования позволяют, не выполняя никаких технологических экспериментов, методом вычислительного эксперимента, варьированием температуры процесса (на модели) определить наибольшую вероятность самопроизвольности конкретной реакции.
Литература:
1. Николаев А.Ф., Охрименко Г.И. Водорастворимые полимеры. [Текст] – Л.: Химия. – 1979. – 61 с.
2. Полиакриламид [Текст] / Под ред. В.Ф. Куренкова. – М.: Химия. – 1992. – 192 с.
3. Сталл Д., Вэстрам Э., Зинге Г. Химическая термодинамика органических соединений. [Текст] М.: Мир. – 1971. – 809 с.
4. Карякин Н.В. Основы химической термодинамики. [Текст] М.: Издательский центр «Академия». – 2003. – 464 с.
5. Koch W. A Chemisť Guide to Density Functional Theory. Wiley – VCN. 2001.-293 p.
6. Becke A.D. Density‐functional thermochemistry. III. The role of exact exchange. [Текст] // J. Chem. Phys. 1993. – Vol. 98. – P. 5648.
7. Lee C., Yang W., Parr R.G. Development of the Colle-Salvetti correlation-energy formula into a functional of the electron density. [Текст] // Phys. Rev. 1988. – Vol. 37. – P.785.
8. Минкин В.И., Симкин Б.Я., Миняев Р.М. Теория строения молекул. [Текст] Ростов-на-Дону: Феникс. – 1997. – 560 с.
9. Самуилов А.Я., Валеев А.Р., Балабанова Ф.Б., Самуилов Я.Д., Коновалов А.И. Квантовохимическое изучение термодинамики реакций этиленкарбоната с метанолом [Текст] // Журн. общей химии. – 2013. – Т. 83. – № 10. – С. 1630-1633.
10. Кравченко, Е. И., Петров В. В. Исследование свойств газочувствительных материалов состава SiO2SnOxCuOy, используемых в сенсорах газов мультисенсорной системы мониторинга атмосферного воздуха [Электронный ресурс] // «Инженерный вестник Дона», 2012, №4 (ч.2). – Режим доступа: http://www.ivdon.ru/magazine/archive/n4p2y2012/1345 (доступ свободный) - Загл. с экрана. – Яз. рус.
11. Каспржицкий, А.С., Лазоренко, Г. И., Явна, В. А. Моделирование ab initio электронной структуры слоистых алюмосиликатов [Электронный ресурс] // «Инженерный вестник Дона», 2013, №3. – Режим доступа: http://www.ivdon.ru/magazine/archive/n3y2013/1861 (доступ свободный) - Загл. с экрана. – Яз. рус.