Биотехнологии и энергетика фотосинтеза
Аннотация
Дата поступления статьи: 27.05.2014Рассматривается фотосинтез, посредством которого органический мир получает запас свободной энергии и обеспечивает химической энергией все биоорганизмы. Выделены основные этапы фотосинтеза: фотофизический, фотохимический, химический и рассматрены энергетические критерии фотосинтеза на основе представлений о пространственно-энергетическом параметре (Р-параметре).
Ключевые слова: Биотехнологии, энергия, биомасса, фотосинтез, пространственно-энергетический параметр.
Биомасса – пятый по производительности возобновимый источник энергии после прямой солнечной, ветровой, гидро и геотермальной энергии. Ежегодно на земле образуется около 170 млрд т. первичной биологической массы и приблизительно тот же объём разрушается. Биомасса — крупнейший по использованию в мировом хозяйстве возобновляемый ресурс (более 500 млн т.у.т./год). Биомасса применяется для производства тепла, электроэнергии, биотоплива, биогаза (метана, водорода). Биомасса делает запас энергии с помощью очень сложного процесса – фотосинтеза [1, 2].
Это – единственный процесс природы, посредством которого органический мир получает запас свободной энергии и обеспечивает химической энергией все биоорганизмы [3].
Обычно выделяются как основные этапы фотосинтеза: фотофизический, фотохимический, химический.
В данной работе рассматриваются энергетические критерии фотосинтеза на основе представлений о пространственно-энергетическом параметре (Р-параметре) [4].
На первом этапе фотосинтеза в системе ФС-2 под действием излучения с энергией hn в структурированных молекулах воды могут измениться размерные характеристики атомов водорода от боровского радиуса (0,529 Å) до – атомного («металлического») – 0,46 Å, что соответствует получению водородом РЭ-параметра, равного 10,432 эВ, близкого к значению РЭ-параметра 2Mg. Отметим так же, что общее изменение в шкале потенциалов фотосинтеза ФС-2 примерно равно 1,5 эВ, а разность данных Р-параметров атомов водорода равна 1,37 эВ.
Остальные атомы водорода с «боровским» РЭ-параметром, равным 9,0624 эВ, имеют близкие значения с РЭ-параметрами 2Р1-орбиталей атомов азота, окружающих магний.
Этот начальный процесс завершается участием в нем марганцесодержащей системы, связанной с белками реакционного центра ФС-2. В марганцевом кластере (двухядерном или четырехядерном) под действием излучения может происходить структурная перестройка [5] от одновалентного состояния (4,9369 эВ – это близко к исходным значениям РЭ-параметра Mg) к двухвалентному (9,9414 эВ) и далее – к четырехвалентному состоянию (17,518 эВ) [3].
Все это обеспечивает ферментативное воздействие Mn на связь Н-О-Н как на атомы водорода и кислорода, так и на гидроксильную группу в целом. Это подтверждается в частности примерным равенством РЭ-параметров двух- и четырехвалентного Mn с РЭ-параметрами 2Р1 и 2Р2-орбиталей атомов кислорода. Таким образом, индуцированные светом все перечисленные выше взаимодействия и структурные перегруппировки приводят к образованию окисленного хлорофилла по реакции [6] с выделением двух электронов и двух протонов:
Н2О+2hn→(1/2)О2+2е-+2Н+ (1)
Другими словами, на первом этапе происходит поглощение квантов света пигментами, их переход в возбуждённое состояние и передача энергии к другим молекулам фотосистемы.
На втором этапе происходит разделение зарядов в реакционном центре, перенос электронов по фотосинтетической электронотранспортной цепи, что заканчивается синтезом АТФ и НАДФН.
Энергия излучения hn в ФС-1 способствует, по-видимому, изменению размерных характеристик атомов фосфора и кислорода от ковалентных до анионных. Поэтому происходит распространение Р0-параметров свободных атомов фосфора и кислорода на расстоянии их анионных радиусов 1,86 Å и 1,40 Å соответственно. Это дает близость значений их РЭ-параметров: α=5,19 % для 2Р3-орбитали фосфора с 2Р2-орбиталями кислорода.
Для расчета энергий связи или энергий восстановления молекул при фотосинтезе (Е) была использована методика, ранее апробированная [7] на 68 бинарных и более сложных соединениях по уравнению:
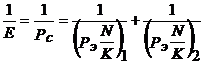 (2)
(2)
где N – средняя кратность связи, К – коэффициент гибридизации, который обычно равен числу учитываемых валентных электронов атома.
В качестве размерной характеристики атомов может использоваться или половина межъядерного расстояния (для бинарной связи) одноименных атомов, или – атомный, ковалентный и ионный радиусы (в зависимости от типа связи).
Для атомов Р и О были проведены расчеты с учетом анионных расстояний атомных орбиталей: 3Р1 (фосфор)-2Р1 (кислород) и для 3Р3 (фосфор)-2Р2 (кислород). Полученные значения Е оказались немного выше экспериментальных, литературных данных. Но реальные энергетические физиологические процессы при фотосинтезе имеют эффективность ниже теоретической, составляя в некоторых случаях около 83 % [6].
Первые два этапа вместе называют светозависимой стадией фотосинтеза. Третий этап происходит уже без обязательного участия света и включает в себя биохимические реакции синтеза органических веществ с использованием энергии, накопленной на светозависимой стадии. Чаще всего в качестве таких реакций рассматривается цикл Кальвина и глюкогенез, образование сахаров и крахмала из углекислого газа воздуха.
Связывание СО2 происходит в водной среде по реакции карбоксилирования рибулозодифосфата (РуБФ) с образованием 3-фосфоглицериновой кислоты (ФГК). Молекула воды и радикал С=О на расстояниях молекулярного взаимодействия имеют достаточно близкие значения РЭ-параметров для образования общей структурной группировки типа димерного композита. Суммарный РЭ-параметр молекулы воды и радикала С=О почти равен РЭ-параметру СО2 и поэтому происходит присоединение молекул СО2 и Н2О к РуБФ с образованием двух радикалов СООН в ФГК. В ферменте РуБФ-карбоксилаза активную роль выполняют атомы Mg и ионы О- (5,4867 эВ и 4,755 эВ), РЭ-параметры которых близки к РЭ-параметру радикала СООН.
Большая разница в числе атомов взаимодействующих структур говорит за то, что карбоксилаза может выполнять только ферментативную роль, «настроенную» на получение данного конечного продукта (СООН).
Дальнейший сложный путь ассимиляции СО2 до образования СН2О идет через ряд промежуточных соединений и реакций (цикл Кальвина). Покажем некоторые результаты расчетов суммарных пространственно-энергетических процессов ассимиляции СО2. При восстановлении углерода от СО2 до уровня структурного образования его в СН2О происходит перестройка химических связей на всех этапах цикла. Поэтому необходима дополнительная энергия активации от АТФ и НАДФН.
Основная часть энергии света запасается растением на этапе восстановления до ФГА. При этом затрагивается 4,56 эВ (на молекулу) – [3]. Наши расчеты дают значение энергии восстановления радикала СОН, равное 4,487 эВ. Свободная энергия образования одного моля СН2О по литературным данным [8, 9] составляет 4,96-5,07 эВ. Расчет по методу Р-параметра оценивает эту энергию, равную 5,025 эВ.
В молекуле ![]() средняя кратность связи атома углерода бралась равной (2+1+1)/3=1,33.
средняя кратность связи атома углерода бралась равной (2+1+1)/3=1,33.
Применяя апробированный подход к расчету результирующей энергии связи (или энергии восстановления) структурных подсистем каждого этапа были рассчитаны величины их энергий– ЕС. Известно [8], что движущая энергия цикла до ФГА может составлять 1,06 эВ за счет трех молекул АТФ (на одну молекулу СО2), причем одна молекула АТФ расходуется в цикле до ФГК.
По данным [3, 10] движущая энергия цикла (ΔЕС) равна разности величин ЕС для соответствующих этапов:
1) этап СО2 – ФГК: ΔЕС=1,770-1,401=0,369 эВ
Энергия фосфорилирования одной молекулы АТФ = 0,34-0,35 эВ
2)этап СО2 – ФГА: ΔЕС=2,367-1,401=0,966 эВ
Энергия фосфорилирования трех молекул АТФ: 0,34х3=1,02 эВ.
Таким образом, метод Р-параметра дает удовлетворительную характеристику энергетики основных этапов цикла ассимиляции СО2.
В данном подходе на основе использования первичных атомных характеристик дается количественная и полуколичественная оценка пространственно-энергетических взаимодействий на главных этапах сложнейшего биофизикохимического процесса фотосинтеза. Анализ результатов применения методологии Р-параметра показывает, что они соответствуют литературным данным и по направлению и по энергетике этих процессов.
Литература:
1. Касьянов,А.С.Энергетический потенциал соломы как биотоплива / А.С. Касьянов [Электронный ресурс] // «Инженерный вестник Дона», 2014. - №1. – Режим доступа: http://www.ivdon.ru/magazine/archive/n1y2014/2225 (доступ свободный) – Загл. С экрана. – Яз. Рус.
2. Шегельман И. Р., Щукин П. О., Морозов М. А. Ресурсные вызовы в области региональной биоэнергетики и пути их преодоления [Электронный ресурс] // «Инженерный вестник Дона», 2012. - №2. – Режим доступа: http://www.ivdon.ru/magazine/archive/n2y2012/819 (доступ свободный) – Загл. С экрана. – Яз. Рус.
3. Korablyov, G.A. Energy Criterions of Photosynthesis / G.A. Korablyov, G.E. Zaikov // Progress in Chemistry and Biochemistry, kinetics, Thermodynamics, Synthesis, Properties and Applications: Festschrift in Honor of the 75th Birthday of Professor Gennady E. Zaikov. – New York, 2009. – Volume 3. – P. 377-392.
4. Korablev G.A. Spatial-Energy Principles of Complex Structures Formation, Netherlands, Brill Academic Publishers and VSP, 2005,426 p. (Monograph).
5. Клейтон Р. Фотосинтез. Физические механизмы и химические модели [Текст] // М.: Мир, 1984. – 350 с.
6. Холл Д., Рао К. Фотосинтез [Текст] // М.: Мир, 1983. – 134 с.
7. Korablev G.A., Zaikov G.E. Energy of chemical bond and spatial-energy principles of hybridization of atom orbitals // Journal of Applied Polymer Science. USA, 2006, V.101, №3, P. 2101-2107.
8. Фотосинтез /Под ред. Говинжи. М.:Мир [Текст] // т.1-1987, 728с; Т.2-1987. – 460 с.
9. Эдвардс Дж., Уокер Д. Фотосинтез С3 и С4-растений: Механизмы и регуляция [Текст] // М.: 1986. – 134 с.
10. Korablyov, G.A. Photosyntesis Structural Interaction / G.A. Korablyov, G.E. Zaikov // Journal of Characterization and Development of Novel Materials Journals. – 2011. – Volume 3, Issue. 3-4. – P. 215-230.